Un equipo de expertos ha determinado la estructura atómica cristalina y el mecanismo de acción de una enzima esencial para eliminar del cuerpo ciertos compuestos no nutritivos, como fármacos, residuos industriales y compuestos tóxicos. El mecanismo de acción que se ha logrado detallar ayudará a los científicos a entender cómo se eliminan estos compuestos y por qué razón falla en algunos casos.
(NC&T) El trabajo es obra de especialistas del Laboratorio Nacional de Brookhaven, el Centro de Biología Estructural de Nueva York, y la compañía SGX Pharmaceuticals. Buena parte de las sustancias no nutritivas ajenas al cuerpo, como medicamentos y productos químicos industriales, son insolubles en agua. El cuerpo usa dos grupos principales de enzimas (las FMO y los citocromos P450), para convertir estos compuestos en formas solubles que puedan ser fácilmente excretadas. Para las FMO, el resultado final (la incorporación de un átomo de oxígeno para hacer estos compuestos solubles) es simple, pero las reacciones requieren de participantes adicionales, o cofactores. Para entender el mecanismo molecular, los científicos usaron haces de rayos X de alta intensidad con el fin de identificar las posiciones de átomos individuales y producir estructuras cristalinas de la enzima, la enzima más su cofactor, y la enzima y el cofactor más el compuesto a ser oxidado (el substrato). Estas estructuras cristalinas constituyen instantáneas graduales de diferentes etapas de la acción catalítica, y revelan un mecanismo diferente al que se aceptaba. 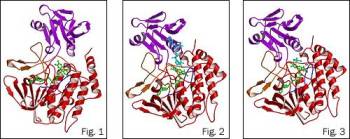 | | (Las tres etapas en el mecanismo de acción
de la FMO.) (Foto: BNL) | |
Anteriormente se creía que todos los "actores" (enzima, cofactor y substrato) se juntaban al mismo tiempo para transferir un átomo de oxígeno de la enzima al substrato. El nuevo descubrimiento revela que el substrato y el cofactor se enlazan a la enzima alternadamente, no de manera simultánea. Primero, el cofactor (conocido como NADPH) se enlaza a una molécula denominada FAD, que es una coenzima vinculada a la FMO, transfiriéndole un ión hidruro. Eso permite al grupo FAD aceptar oxígeno molecular. Entonces, cuando el substrato llega, el cofactor sale a fin de que el substrato pueda enlazarse al mismo lugar en el grupo FAD. En este momento, un átomo de oxígeno del oxígeno molecular se enlaza al substrato, y el ión hidruro obtenido del cofactor se combina con el otro átomo de oxígeno para formar una molécula de agua, que es liberada. Una vez que el substrato es oxigenado, deja la enzima y el cofactor se enlaza otra vez. |
|
