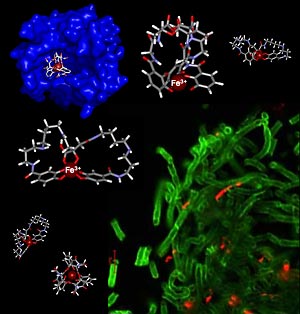
 | | (En verde, la bacteria del ántrax segrega dos
moléculas para buscar hierro
Sólo una, la bacilibactina,
es interceptada por la siderocalina,
en azul.) (Foto: Raymond Lab/UC Berkeley) | |
|---|
La bacteria del ántrax produce dos pequeñas moléculas: bacilibactina y petrobactina, que extraen el hierro de la molécula transportadora en el ser humano, llamada transferrina. Estos "sideróforos" son esenciales para que el ántrax crezca rápidamente, sobre todo después de que la víctima haya inhalado las esporas, aunque no se comprendía por qué la bacteria necesita dos sideróforos para operar. El nuevo estudio muestra por qué la bacteria del ántrax requiere dos sideróforos actuando mediante dos mecanismos distintos. La siderocalina, proteína inmunológica humana, se enlaza a la bacilibactina y la deja inoperante, tal y como constataron los investigadores. Al parecer, el ántrax "contraataca" valiéndose de un segundo y sigiloso "ladrón" de hierro, la petrobactina, mientras las defensas humanas se concentran contra el primer "ladrón". La siderocalina no se enlaza a la petrobactina. Hasta donde se sabe, el sistema inmunológico humano aún no ha podido lanzar un contraataque eficaz contra el segundo sideróforo, "pero eso no significa que no podamos diseñar algo contra él", señala Ken Raymond, profesor de química en la Universidad de California en Berkeley. Él y sus colegas están estudiando cómo usar el hallazgo para diagnosticar o tratar el ántrax. |
